FENÓMENOS BIOFÍSICOS
Los fenómenos
físicos son todos aquellos que no cambian en la estructura interna de la
materia. Los fenómenos químicos son aquellos que cambian la estructura interna
de la materia. Los fenómenos biofísicos moleculares son procesos que se realizan
en los seres vivos, los cuales se basan en leyes físicas y físico-químicas
dando lugar a la formación de dichos fenómenos. Los fundamentos moleculares de
la Biofísica se rigen en las biomoléculas, o macromoléculas, y su
funcionamiento en todo aspecto.
Fenómenos de
superficie: Varios de los procesos biológicos tienen
que ver con los diferentes fenómenos que suceden en una superficie de contacto,
que se encuentran especialmente separadas en pequeñas partículas. Estas
superficies se les conoce con el nombre de interfaces y los fenómenos que en
estas ocurren se les conoce como fenómenos de superficie. En conclusión los
fenómenos de superficie son varios fenómenos que se producen en una superficie
de contacto la cual se encuentra distanciada por partículas muy pequeñas. Las
fuerzas de cohesión y de repulsión intermolecular influyen en las propiedades
que se encuentran en la materia, tales como: el punto de ebullición, de fusión,
el calor de vaporización y la tensión superficial.
Dentro de una
interface, rodeando a una molécula se presentan atracciones proporcionadas; en
cambio en la superficie, dicha molécula se encuentra únicamente rodeada por
moléculas que son atraídas hacia el interior del líquido por las moléculas que
la rodean, al realizar dicho proceso el líquido se comporta como si estuviera
rodeado por una membrana invisible.
Bibliografía
Pérez, M. E.
(s.f.). Academia. Obtenido de
http://www.academia.edu/30926393/FENOMENOS_BIOFISICOS_MOLECULARES
https://hernanleon1002.wordpress.com/fisica-de-fluidos-y-termodinamica/segundo-corte/marco-teorico/tension-superficial/


DIFUSIÓN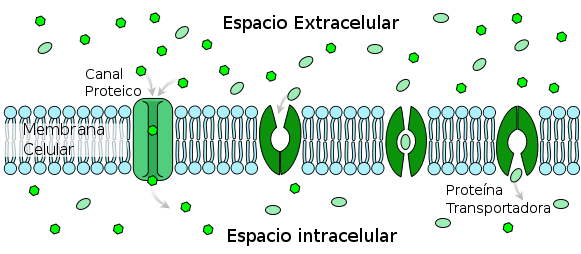


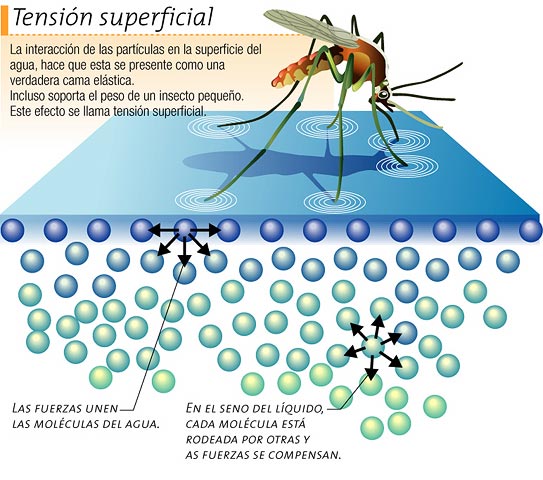
TENSIÓN SUPERFICIAL
En física se
denomina tensión superficial de un líquido a la cantidad de energía necesaria
para aumentar su superficie por unidad de área. Esta definición implica que el
líquido tiene una resistencia para aumentar su superficie. Este efecto permite
a algunos insectos, como el zapatero, desplazarse por la superficie del agua
sin hundirse. La tensión superficial (una manifestación de las fuerzas
intermoleculares en los líquidos), junto a las fuerzas que se dan entre los
líquidos y las superficies sólidas que entran en contacto con ellos, da lugar a
la capilaridad.
Las fuerzas
cohesivas entre las moléculas de un líquido, son las responsables del
fenómeno conocido como tensión superficial. Las moléculas de superficie no
tienen otras iguales sobre todos sus lados, y por lo tanto se cohesionan más
fuertemente, con aquellas asociadas directamente en la superficie. Esto forma
una película de superficie, que hace más difícil mover un objeto a través de la
superficie, que cuando está completamente sumergido.
La tensión superficial, se mide normalmente en dinas/cm., la fuerza que se requiere (en dinas) para romper una película de 1 cm. de longitud. Se puede establecer de forma equivalente la energía superficial en ergios por centímetro cuadrado. El agua a 20°C tiene una tensión superficial de 72.8 dinas/cm comparada con 22.3 para el alcohol etílico y 465 para el mercurio.
La tensión superficial, se mide normalmente en dinas/cm., la fuerza que se requiere (en dinas) para romper una película de 1 cm. de longitud. Se puede establecer de forma equivalente la energía superficial en ergios por centímetro cuadrado. El agua a 20°C tiene una tensión superficial de 72.8 dinas/cm comparada con 22.3 para el alcohol etílico y 465 para el mercurio.

https://hernanleon1002.wordpress.com/fisica-de-fluidos-y-termodinamica/segundo-corte/marco-teorico/tension-superficial/
Bibliografía
Pérez, M. E. (s.f.). Academia. Obtenido de
http://www.academia.edu/30926393/FENOMENOS_BIOFISICOS_MOLECULARES
PRESIÓN HIDROESTÁTICA
Es la fuerza por
unidad de área que ejerce un líquido en reposo sobre las paredes del recipiente
que lo contiene y sobre cualquier cuerpo que se encuentre sumergido, como esta
presión se debe al peso del líquido, esta presión depende de la densidad(p), la
gravedad(g) y la profundidad(h) del el lugar donde medimos la presión (P).
(P)P=p*g*h
Un fluido pesa y
ejerce presión sobre las paredes sobre el fondo del recipiente que lo contiene
y sobre la superficie de cualquier objeto sumergido en él.
Esta presión,
llamada presión hidrostática, provoca, en fluidos en reposo, una fuerza
perpendicular a las paredes del recipiente o a la superficie del objeto
sumergido sin importar la orientación que adopten las caras. Si el líquido
fluyera, las fuerzas resultantes de las presiones ya no serían necesariamente
perpendiculares a las superficies.
Bibliografía
Pérez, M. E. (s.f.). Academia.
Obtenido de http://www.academia.edu/30926393/FENOMENOS_BIOFISICOS_MOLECULARES
ADHESIÓN
Unas gotas de agua
adhiriéndose a una telaraña. El mortero usado para mantener y sostener juntos
los ladrillos es un ejemplo de la adhesión. La adhesión es la propiedad de la
materia por la cual se unen dos superficies de sustancias iguales o diferentes
cuando entran en contacto, y se mantienen juntas por fuerzas intermoleculares.
La adhesión es
la propiedad de la materia por la cual se unen dos superficies de
sustancias iguales o diferentes cuando entran en contacto, y se mantienen
juntas por fuerzas intermoleculares.
La adhesión ha
jugado un papel muy importante en muchos aspectos de las técnicas de
construcción tradicionales. La adhesión del ladrillo con el
mortero (cemento) es un ejemplo claro.
La
cohesión es distinta de la adhesión. La cohesión es la fuerza de atracción
entre partículas adyacentes dentro de un mismo cuerpo, mientras que la
adhesión es la interacción entre las superficies de distintos cuerpos.
https://study.com/academy/lesson/differences-between-cohesion-and-adhesion.html
COHESIÓN
Es la atracción
entre moléculas que mantiene unidas las partículas de una sustancia. La
cohesión es diferente de la adhesión; la cohesión es la fuerza de atracción
entre partículas adyacentes dentro de un mismo cuerpo, mientras que la adhesión
es la interacción entre las superficies de distintos cuerpos. En el agua la
fuerza de cohesión es elevada por causa de los puentes de hidrogeno que
mantienen las moléculas de agua fuertemente unidas, formando una estructura
compacta que la convierte en un líquido casi incompresible.
Al no poder
comprimirse puede funcionar en algunos animales como un esqueleto hidrostático,
como ocurre en algunos gusanos perforadores capaces de agujerear la roca
mediante la presión generada por sus líquidos internos. Tanto los gases como
los líquidos son fluidos, pero los líquidos tienen una propiedad de la que
carecen los gases: tienen una superficie “libre”, o sea tienen una superficie
cuya forma no está determinada por la forma del recipiente que lo contiene.

https://www.diferencias.cc/absorcion-adsorcion/
Bibliografía
XD. (02 de junio de 2012). Obtenido de
http://tenopalarr.blogspot.com/2012/06/cohesion-adhesion-tension-superficial.html
ACCIÓN CAPILAR
La acción capilar es el resultado de
la adhesión y la tensión superficial. La adhesión del agua a las
paredes de un recipiente, originará una fuerza hacia arriba sobre los bordes
del líquido y como resultado su ascenso sobre la pared. La tensión superficial,
actúa para mantener intacta la superficie del líquido, de modo que en vez de
solo moverse los bordes hacia arriba, toda la superficie entera del líquido es
arrastrada hacia arriba.
CAPILARIDAD
La capilaridad es
la cualidad que posee una sustancia de adsorber a otra. Sucede cuando las
fuerzas intermoleculares adhesivas entre el líquido y el sólido son mayores que
las fuerzas intermoleculares cohesivas del líquido. Esto causa que el menisco
tenga una forma cóncava cuando el líquido está en contacto con una superficie
vertical. En el caso del tubo delgado, éste succiona un líquido incluso en
contra de la fuerza de gravedad. Este es el mismo efecto que causa que materiales
porosos absorban líquidos.
Un aparato
comúnmente empleado para demostrar la capilaridad es el tubo capilar; cuando la
parte inferior de un tubo de vidrio se coloca verticalmente, en contacto con un
líquido como el agua, se forma un menisco cóncavo; la tensión superficial
succiona la columna líquida hacia arriba hasta que el peso del líquido sea
suficiente para que la fuerza de la gravedad se equilibre con las fuerzas
intermoleculares.
Dos placas de
vidrio que están separadas por una película de agua de 1 µm (micrómetro) de
espesor, se mantienen unidas por una presión de succión de 1,5 atm. Por ello se
rompen los portaobjetos humedecidos, cuando se trata de separarlos.
https://dianayazminrojas.wordpress.com/segundo-corte/fenomeno-de-capilaridad/
Bibliografía
Hiper
Physic. (s.f.). Hiper Physic. Obtenido de
http://hyperphysics.phy-astr.gsu.edu/hbasees/surten2.html
DIFUSIÓN
Al proceso por el
cual se produce un flujo neto de moléculas pasa a través de una membrana
permeable sin que exista un aporte externo de energía. Este proceso, que en
última instancia se encuentra determinado por una diferencia de concentración
entre los dos medios separados por la membrana; no requiere de un aporte de
energía debido a que su principal fuerza impulsora es el aumento de la entropía
total del sistema.
En este proceso el
desplazamiento de las moléculas se produce siguiendo el gradiente de concentración,
las moléculas atraviesan la membrana desde el medio donde se encuentran en
mayor concentración, hacia el medio donde se encuentran en menor concentración.
El proceso de
difusión simple se encuentra descrito por las Leyes de Fick, las cuales relacionan
la densidad del flujo de las moléculas con la diferencia de concentración entre los dos medios
separados por la membrana, el coeficiente de difusión de las mismas y la
permeabilidad de la membrana.
El proceso de
difusión simple es de vital importancia para el transporte de moléculas
pequeñas a través de las membranas celulares.

https://www.lifeder.com/difusion-simple/
Bibliografía
Hiper
Physic. (s.f.). Hiper Physic. Obtenido de http://hyperphysics.phy-astr.gsu.edu/hbasees/Kinetic/diffus.html
ÓSMOSIS
La ósmosis es el fenómeno que se produce
cuando dos soluciones con diferente concentración son separadas por una
membrana semipermeable y el solvente difunde a través de la membrana del
líquido de menor concentración al de mayor hasta equilibrar las
concentraciones. Este fenómeno se produce de forma espontánea sin gasto
energético.
En otras palabras, si tuviéramos dos disoluciones de agua y sal
separadas por una membrana semipermeable (que sólo permite pasar el agua); el agua se movería de la disolución de
menor concentración a la de mayor concentración sin
necesidad de aportar energía.
Según la concentración de solventes y solutos (por ejemplo, el
agua sería el solvente y la sal el soluto en el ejemplo anterior) se pueden
clasificar los medios en:
· Hipotónicos: cuando la concentración de soluto es menor respecto al medio
con el que se compara
· Hipertónico: cuando la concentración de soluto es mayor respecto al medio con
el que se compara.
· Isotónico: cuando ambos medios
tienen la misma concentración.
A la
presión que ejerce el solvente (agua) sobre la cara de la membrana donde hay
menor concentración hacia el compartimento de mayor concentración se le
denomina presión osmótica. Siguiendo con la
terminología anterior la presión que se produce en el lado de la membrana
del medio hipotónico hacia el hipertónico es la presión osmótica.
PRESIÓN OSMÓTICA
Se entiende
por presión osmótica al nivel
de fuerza que debe
aplicarse sobre una solución cuando se necesita frenar el flujo de disolvente
por medio de una membrana de características semipermeables.
Esta particularidad resulta muy importante para entender las relaciones que se
establecen entre los líquidos que forman parte de los seres vivos.
La membrana
semipermeable, pues, permite que pasen las moléculas de
disolvente pero impide el avance de las moléculas del soluto. Esto hace que las
moléculas del disolvente se difundan y puedan pasar desde una solución con
menor concentración a otra con mayor concentración.

https://cienciaybiologia.com/osmosis/
Bibliografía
Ciencia y Biologia. (s.f.). Ciencia
y Biologia. Obtenido de https://cienciaybiologia.com/osmosis/
DIÁLISIS
La diálisis es el proceso
de separar las moléculas en una solución por la diferencia en sus índices de
difusión o presión osmótica a través de una membrana semipermeable.
La diálisis es una
técnica común de laboratorio, y funciona con el mismo principio que diálisis
médica. Típicamente una solución de varios tipos de moléculas es puesta en un
bolso semipermeable de diálisis, como por ejemplo, en una membrana de la
celulosa con poros, y el bolso es sellado.

Bibliografía
Carola, T. (2004). UNNE.
Obtenido de http://ufq.unq.edu.ar/Docencia-Virtual/BQblog/Dialisis%20y%20ultrafiltracion.pdf
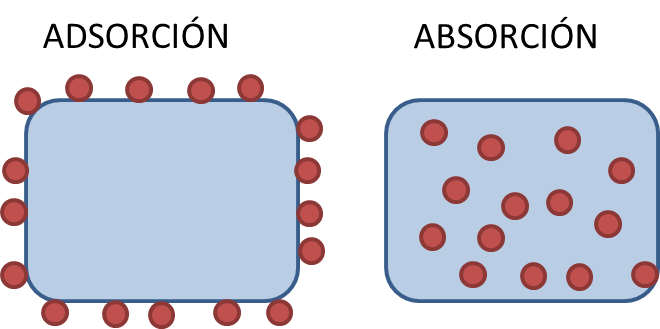
ADSORCIÓN
La adsorción es el fenómeno de sorción en el
que una sustancia A (adsorbato)
presente en una fase fluida (líquido o gas) queda adherida a la
superficie de una sustancia B en fase sólida (adsorbente). No hay transferencia de
masa entre las fases, sino que el adsorbato crea una capa
superficial sobre el adsorbente.
La adsorción se puede producir también por fenómenos físicos o químicos.
Por ejemplo, el adsorbato puede quedar fijado en la superficie por atracción
eléctrica o por fuerzas de van der Waals, ambos fenómenos físicos (fisisorción), pero también puede quedar
adherido por formación de un enlace químico, es decir, con intercambio de
electrones (quimisorción).
La adsorción es un fenómeno exotérmico que
ocurre de forma espontánea hasta que el adsorbente queda saturado. La capacidad
de adsorción, al ser un fenómeno superficial, depende en gran medida de la
superficie expuesta del adsorbente. La mayoría de adsorbentes comerciales se
distribuyen en forma microcristalina para aumentar la superficie por volumen.
Por ejemplo, el carbón activado presenta superficies de hasta 1200 m2 por gramo de producto. Otros
adsorbentes muy utilizados son el gel de sílice, la alúmina activada y la
zeolita.
https://sites.google.com/site/laboratoriodefisicoquimica/adsorcion
Bibliografía
Curiosoando. (s.f.). Curiosoando.
Obtenido de https://curiosoando.com/que-diferencia-absorcion-y-adsorcion


No hay comentarios:
Publicar un comentario